商铺名称:深圳市肯达信企业管理顾问有限公司
联系人:陈小姐(小姐)
联系手机:
固定电话:
企业邮箱:2851160899@qq.com
联系地址:
邮编:
联系我时,请说是在地方电气网上看到的,谢谢!
商品详情
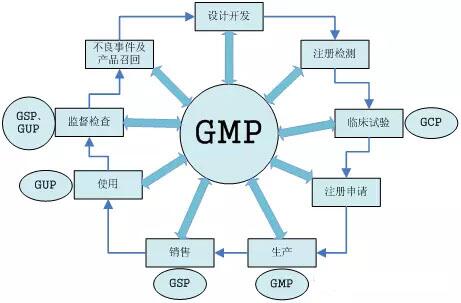
医疗器械注册质量管理体系核查
受理条件
(1)具有申请医疗器械注册证核发受理通知书
(2)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;企业应当具有与所生产产品及生产规模相适应的生产设备,生产、仓储场地和环境。企业生产对环境和设备等有特殊要求的医疗器械的,应当符合国家标准、行业标准和国家有关规定;
(3)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;企业的生产、质量和技术负责人应当具有与所生产医疗器械相适应的专业能力,并掌握国家有关医疗器械监督管理的法律、法规和规章以及相关产品质量、技术的规定,质量负责人不得同时兼任生产负责人;
(4)有保证医疗器械质量的管理制度;
(5)有与生产的医疗器械相适应的售后服务能力;
(6)符合产品研制、生产工艺文件规定的要求;
(7)企业应当保存与医疗器械生产和经营有关的法律、法规、规章和有关技术标准。
网上办理流程:
1.申请 申请人通过网上方式提出申请,根据申请材料的要求提交申请材料。
(1)申报人必须通过省政务服务网进行申报,如需补充纸质材料(如无法上传的图纸等特殊格式文件),请于网上申报完成后直接网上提交申请。
(2)接收部门:广东省药品监督管理局业务受理处。 接收地址:广州市东风东路753号之二1楼受理大厅
(3)网上申报不限时间,业务受理处办公时间:每周一至周五上午9:00—12:00,下午13:00—17:00(逢周五下午不对外办公) 2.受理
办理机关收到申请材料之日起在5个工作日内作出受理或不予受理决定。
经审查,材料不全或不符合法定形式的,办理机关应在5个工作日内一次性告知申请人需补正的全部内容。 3.获取办理结果
实施机关决定予以通过的,申请人可获得医疗器械注册质量管理体系核查结果通知单。
实施机关决定不予通过的,申请人可获得医疗器械注册质量管理体系核查结果通知单,其中中应说明不予通过的理由。
实施机关自作出结果决定之日起10个工作日内在网上公开办理结果,并告知申请人。 我局提供办理结果免费邮寄服务,申请人无需到我局受理大厅领取
申请材料
1注册申请人基本情况表
2企业总平面布置图、生产区域分布图
3注册申请人组织机构图
4如生产过程有净化要求的应提供有资质的检测机构出具的环境监测报告(附平面布局图)复印件
5产品生产工艺流程图,应标明主要控制点与项目及主要原材料,采购件的来源及质量控制方法
6主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验设备,如需净化生产的,还应提供环境监测设备)目录
7企业质量管理体系自查报告
8拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
9部分注册申报资料,请参考填报须知
10注册受理凭证
11申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的的承诺
12减免医疗器械注册质量管理体系核查申请
13相同生产地址通过相同生产范围产品医疗器械注册质量管理体系核查结果
14相同生产范围的医疗器械注册证
15样品真实性保证声明
受理条件
(1)具有申请医疗器械注册证核发受理通知书
(2)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;企业应当具有与所生产产品及生产规模相适应的生产设备,生产、仓储场地和环境。企业生产对环境和设备等有特殊要求的医疗器械的,应当符合国家标准、行业标准和国家有关规定;
(3)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;企业的生产、质量和技术负责人应当具有与所生产医疗器械相适应的专业能力,并掌握国家有关医疗器械监督管理的法律、法规和规章以及相关产品质量、技术的规定,质量负责人不得同时兼任生产负责人;
(4)有保证医疗器械质量的管理制度;
(5)有与生产的医疗器械相适应的售后服务能力;
(6)符合产品研制、生产工艺文件规定的要求;
(7)企业应当保存与医疗器械生产和经营有关的法律、法规、规章和有关技术标准。
网上办理流程:
1.申请 申请人通过网上方式提出申请,根据申请材料的要求提交申请材料。
(1)申报人必须通过省政务服务网进行申报,如需补充纸质材料(如无法上传的图纸等特殊格式文件),请于网上申报完成后直接网上提交申请。
(2)接收部门:广东省药品监督管理局业务受理处。 接收地址:广州市东风东路753号之二1楼受理大厅
(3)网上申报不限时间,业务受理处办公时间:每周一至周五上午9:00—12:00,下午13:00—17:00(逢周五下午不对外办公) 2.受理
办理机关收到申请材料之日起在5个工作日内作出受理或不予受理决定。
经审查,材料不全或不符合法定形式的,办理机关应在5个工作日内一次性告知申请人需补正的全部内容。 3.获取办理结果
实施机关决定予以通过的,申请人可获得医疗器械注册质量管理体系核查结果通知单。
实施机关决定不予通过的,申请人可获得医疗器械注册质量管理体系核查结果通知单,其中中应说明不予通过的理由。
实施机关自作出结果决定之日起10个工作日内在网上公开办理结果,并告知申请人。 我局提供办理结果免费邮寄服务,申请人无需到我局受理大厅领取
申请材料
1注册申请人基本情况表
2企业总平面布置图、生产区域分布图
3注册申请人组织机构图
4如生产过程有净化要求的应提供有资质的检测机构出具的环境监测报告(附平面布局图)复印件
5产品生产工艺流程图,应标明主要控制点与项目及主要原材料,采购件的来源及质量控制方法
6主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验设备,如需净化生产的,还应提供环境监测设备)目录
7企业质量管理体系自查报告
8拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
9部分注册申报资料,请参考填报须知
10注册受理凭证
11申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的的承诺
12减免医疗器械注册质量管理体系核查申请
13相同生产地址通过相同生产范围产品医疗器械注册质量管理体系核查结果
14相同生产范围的医疗器械注册证
15样品真实性保证声明
在线询盘/留言














